Đường parabol toán 10: cách vẽ và lập phương trình cực dễ hiểu
Lý thuyết kết hợp với bài tập về cách vẽ và lập phương trình đường parabol toán lớp 10.
FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O là phản xạ lão hóa khử. Bài viết lách này cung ứng không thiếu vấn đề về phương trình chất hóa học đã và đang được cân đối, ĐK những hóa học nhập cuộc phản xạ, hiện tượng kỳ lạ (nếu có), ... Mời chúng ta đón xem:
Phản ứng FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O
Bạn đang xem: FeO + HNO3 loãng → Fe(NO3)3 + NO + H2O | FeO ra Fe(NO3)3 | HNO3 ra Fe(NO3)3 | HNO3 ra NO
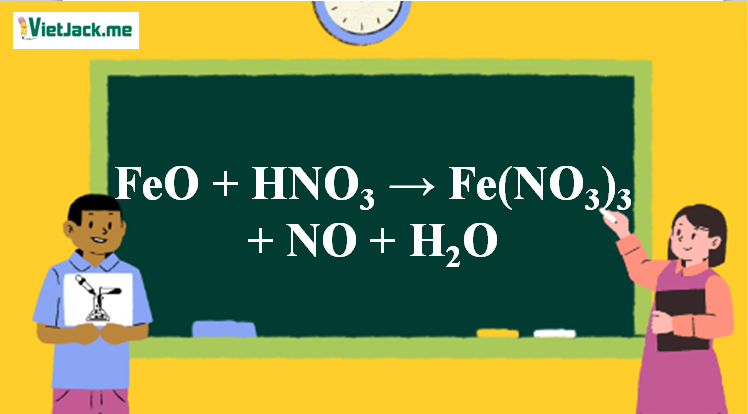
1. Phương trình phản xạ FeO tính năng HNO3 loãng
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2. Cân vị phương trình FeO + HNO3 → Fe(NO3)3 + NO + H2O
Fe+2O + HN+5O3 → Fe+3(NO3)3 + N+2O + H2O
Ta có:
|
3x 1x |
Fe2+ → Fe3+ + 1e N+5 + 3e → N+2 |
Phương trình phản ứng:
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
3. Điều khiếu nại phản xạ thân thiết FeO và axit HNO3 loãng
Nhiệt độ
4. Cách tổ chức phản xạ thân thiết FeO và axit HNO3 loãng
Cho oxit Fe II tính năng với hỗn hợp axit HNO3.
5. Hiện tượng phản xạ FeO và axit HNO3 loãng
Chất rắn black color Sắt II Oxit (FeO) tan dần dần và xuất hiện tại khí Nito oxit (NO) hóa nâu ngoài bầu không khí.
6. Bản hóa học của những hóa học nhập cuộc phản ứng
6.1. Bản hóa học của FeO (Sắt (II) oxit)
- Trong phản xạ bên trên FeO là hóa học khử.
- FeO thể hiện tại tính khử Lúc tính năng với những hóa học sở hữu tính oxi hoá mạnh như HNO3 và H2SO4 quánh.
6.2. Bản hóa học của HNO3 (Axit nitric)
- Trong phản xạ bên trên HNO3 là hóa học oxi hoá.
- HNO3 tác dụng với oxit bazo, bazo, muối bột nhưng mà sắt kẽm kim loại nhập phù hợp hóa học ko lên hoá trị tối đa.
7. Tính hóa chất của FeO
Các phù hợp hóa học Fe (II) sở hữu cả tính khử và tính lão hóa tuy nhiên tính khử đặc thù rộng lớn, vì thế trong những phản xạ chất hóa học ion Fe2+ dễ dàng nhượng bộ 1e trở thành ion Fe3+:
Fe2+ + 1e → Fe3+
7.1. Tính hóa học đặc thù của phù hợp hóa học Fe (II) là tính khử.
Các phù hợp hóa học Fe (II) thông thường tầm thường bền dễ dẫn đến lão hóa trở thành phù hợp hóa học Fe (III).
FeO là một trong những oxit bazơ, ngoại giả, vì thế sở hữu số lão hóa +2 – số lão hóa trung gian trá => FeO sở hữu tính khử và tính lão hóa.
FeO là một trong những oxit bazơ:
7.2. Tác dụng với hỗn hợp axit: HCl; H2SO4 loãng…
FeO + 2HCl → FeCl2+ H2
FeO + H2SO4 loãng → FeSO4 + H2O
FeO là hóa học lão hóa Lúc tính năng với những hóa học khử mạnh: H2, CO, Al → Fe:
FeO + H2 Fe + H2O
FeO + CO Fe + CO2
3FeO + 2Al Al2O3 + 3Fe
FeO là hóa học khử Lúc tính năng với những hóa học sở hữu tính lão hóa mạnh: HNO3; H2SO4 đặc; O2…
4FeO + O2 2Fe2O3
3FeO + 10HNO3 loãng→ 3Fe(NO3)3 + NO + 5H2O
FeO + 4HNO3 quánh,giá → Fe(NO3)3 + NO2 + 2H2O
2FeO + 4H2SO4 quánh, giá → Fe2(SO4)3 + SO2 + 4H2O
7.3. Ứng dụng của FeO
- FeO được xúc tác với Fe2O3 tạo nên Fe3O4:
Fe2O3 + FeO Tính hóa học của Sắt oxit FeO Fe3O4
Trong công nghiệp, FeO là phù hợp hóa học cần thiết nhằm tính năng với hóa học khử mạnh phát hành rời khỏi sắt:
FeO + H2 Tính hóa học của Sắt oxit FeO Fe + H2O
FeO + CO Tính hóa học của Sắt oxit FeO Fe + CO2
2Al + 3 FeO Tính hóa học của Sắt oxit FeO Al2O3 + Fe
- FeO nhập vật tư gốm rất có thể được tạo hình vị phản xạ khử sắt(III) oxit nhập lò nung. Khi Fe tía đã trở nên khử trở thành Fe nhị nhập men thì đặc biệt khó khăn oxy hoá quay về. Hầu không còn những loại men sẽ sở hữu phỏng hoà tan Fe nhị Lúc nung chảy cao hơn nữa Lúc ở hiện trạng rắn bởi vậy sẽ sở hữu Fe oxit kết tinh ma nhập men Lúc thực hiện nguội, môi trường xung quanh oxy hoá hoặc khử.
8. Tính hóa chất của HNO3
- Axit nitric là một trong những hỗn hợp nitrat hydro sở hữu công thức chất hóa học HNO3 . Đây là một trong những axit khan, là một trong những monoaxit mạnh, sở hữu tính lão hóa mạnh rất có thể nitrat hóa nhiều phù hợp hóa học vô sinh, sở hữu hằng số cân đối axit (pKa) = −2.
- Axit nitric là một trong những monoproton có duy nhất một sự phân ly nên nhập hỗn hợp, nó bị năng lượng điện ly trọn vẹn trở thành những ion nitrat NO3− và một proton hydrat, hoặc hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric sở hữu đặc điểm của một axit thông thường nên nó thực hiện quỳ tím gửi quý phái red color.
- Tác dụng với bazo, oxit bazo, muối bột cacbonat tạo nên trở thành những muối bột nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tính năng với kim loại: Tác dụng với đa số những sắt kẽm kim loại trừ Au và Pt tạo nên trở thành muối bột nitrat và nước .
Kim loại + HNO3 đặc → muối bột nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối bột nitrat + NO + H2O
Kim loại + HNO3 loãng giá thành → muối bột nitrat + H2
Mg(rắn) + 2HNO3 loãng giá thành → Mg(NO3)2 + H2 (khí)
- Nhôm, Fe, crom thụ động với axit nitric quánh nguội vì thế lớp oxit sắt kẽm kim loại được tạo nên bảo đảm an toàn bọn chúng không trở nên lão hóa tiếp.
- Tác dụng với phi kim (các nhân tố á kim, nước ngoài trừ silic và halogen) tạo nên trở thành nito dioxit nếu như là axit nitric quánh và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
Phường + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối bột nhưng mà sắt kẽm kim loại nhập phù hợp hóa học này ko lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với phù hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan nhập HNO3, HgS ko tính năng với HNO3.
- Tác dụng với rất nhiều phù hợp hóa học hữu cơ: Axit nitric sở hữu kỹ năng đập phá bỏ nhiều phù hợp hóa học cơ học, nên tiếp tục đặc biệt nguy khốn nếu như nhằm axit này xúc tiếp với khung người người.
9. Bài luyện áp dụng liên quan
Câu 1. Cho phản ứng: FeO + HNO3 → Fe(NO3)3 + NO + H2O. Trong phương trình của phản xạ bên trên, Lúc thông số của FeO là 3 thì thông số của HNO3 là
A. 6
B. 10
C. 8
D. 4
Lời giải:
Đáp án: B
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 2. Hòa tan một lượng FexOy vị H2SO4 loãng dư được hỗn hợp X. thạo X vừa phải sở hữu kỹ năng làm mất đi color hỗn hợp dung dịch tím, vừa phải sở hữu kỹ năng hòa tan được bột Cu. Oxit Fe cơ là:
A. FeO
B. Fe2O3
C. Fe3O4
D. A hoặc B
Lời giải:
Đáp án: C
Hòa tan được Cu là đặc điểm của muối bột Fe (III), hít vào được khí Cl2 là đặc điểm của muối bột Fe(II). FexOy hòa tao nhập H2SO4 loãng tạo nên đôi khi muối bột Fe (III) và muối bột Fe (II) là Fe kể từ oxit Fe3O4.
Phương trình hóa học
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
6FeSO4 + 3Cl2 → 2Fe2(SO4)3 + 2FeCl2.
Câu 3. Cách này tại đây rất có thể dùng để làm pha trộn FeO?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 nhập bầu không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS nhập oxi.
Lời giải:
Câu 4. Hòa tan không còn m gam Fe vị 400ml hỗn hợp HNO3 1M. Sau Lúc phản xạ xẩy ra trọn vẹn, nhận được hỗn hợp chứa chấp 26,44 gam hóa học tan và khí NO (sản phẩm khử duy nhất). Giá trị của m là:
A. 7,84
B. 6,12
C. 5,60
D. 12,24
Lời giải:
Đáp án: A
nHNO3 = 0,4 mol ⇒ mHNO3 = 0,4.63 = 25,2 gam
Phương trình hóa học
Fe + 4HNO3 → Fe(NO3)3 + NO + H2O (1)
Phản ứng (1) xẩy ra, lượng hóa học tan giảm xuống, nhưng mà theo gót đề bài xích, lượng hóa học tan là 26,44 gam > 25,2 gam nên xẩy ra phản xạ hoà tan Fe dư
2Fe3+ + Fe → 3Fe2+ (2)
⇒ phản xạ (1) xẩy ra trọn vẹn,
nFe(1) = nHNO3 = 0,1 mol
⇒ mFe(1) = 5,6 gam ⇒ mFe(2) = 26,44 – 0,1.242 = 2,24 gam
mFe = 5,6 + 2,24 = 7,84 gam
Câu 5. Câu tuyên bố này bên dưới đó là chính ?
A. Thép là kim loại tổng hợp của Fe không tồn tại C và sở hữu một không nhiều S, Mn, Phường, Si.
B. Thép là kim loại tổng hợp của Fe sở hữu kể từ 0,01 - 2% C và một không nhiều Si, Mn, Cr, Ni.
C. Thép là kim loại tổng hợp của Fe sở hữu kể từ 2-5% C và một không nhiều S, Mn, p, Si.
D. Thép là kim loại tổng hợp của Fe sở hữu kể từ 5-10% C và một lượng đặc biệt không nhiều Si, Mn, Cr, Ni.
Lời giải:
Câu 6. Dãy những hóa học và hỗn hợp này tại đây Lúc lấy dư rất có thể oxi hoá Fe trở thành Fe (III)?
A. HCl, HNO3 quánh, giá, H2SO4 quánh, nóng
B. Cl2, HNO3 giá, H2SO4 quánh, nguội
C. bột diêm sinh, H2SO4 quánh, giá, HCl
D. Cl2, AgNO3, HNO3 loãng
Lời giải:
Đáp án: D
2Fe + 3Cl2 → 2FeCl3
Fe + 3AgNO3→ Fe(NO3)3 + 3Ag
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
Câu 7. Dung dịch FeSO4 làm mất đi color hỗn hợp này sau đây?
A. Dung dịch K2Cr2O7 nhập môi trường xung quanh H2SO4
B. Dung dịch KMnO4 nhập môi trường xung quanh H2SO4
C. Dung dịch Br2
D. Dung dịch KMnO4 nhập môi trường xung quanh H2SO4, Dung dịch K2Cr2O7 nhập môi trường xung quanh H2SO4 ; Dung dịch Br2
Lời giải:
Đáp án: D
Các hỗn hợp KMnO4/ H2SO4; K2Cr2O7/ H2SO4; Br2 đều là những hóa học lão hóa → Fe2+ sẽ sở hữu phản xạ lão hóa khử làm mất đi color những hỗn hợp trên
10FeSO4 + 2KMnO4 + 8H2SO4→ 5Fe2(SO4)3+ K2SO4+ 2MnSO4+ 8H2O
6FeSO4 + K2Cr2O7+ 7H2SO4 → 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Xem thêm: Sau About là gì? Tổng hợp đầy đủ nhất cấu trúc và cách dùng bạn nhất định phải biết!
Câu 8. Để a gam bột Fe nhập bầu không khí một thời hạn, nhận được 9,6 gam hóa học rắn X. Hoà tan trọn vẹn X nhập hỗn hợp HNO3 loãng (dư), nhận được hỗn hợp Y và khí NO (sản phẩm khử độc nhất của). Cho hỗn hợp NaOH dư nhập Y, nhận được kết tủa, Lọc kết tủa rồi nung ở nhiệt độ phỏng cao cho tới lượng ko thay đổi, nhận được 12,0 gam hóa học rắn. Số mol HNO3 đang được phản xạ là:
A. 0,75.
B. 0,65.
C. 0,55.
D. 0,45.
Lời giải:
Đáp án: C
(a gam Fe + O) → 9,6 gam X (Fe, FeO, Fe2O3, Fe3O4)
+HNO3→ dd Y (Fe3+,H+,NO3- ) + NO)
Y + NaOH (dư) → Fe(OH)3 → Fe2O3 (12 gam)
mO = 9,6 – 8,4 = 1,2 gam
⇒ nFe = 0,15 mol; nO = 0,075 mol
a = = 8,4 gam
mO = 9,6 - 8,4 = 1,2 gam
=> nFe = 0,15 mol; nO = 0,075 mol
Fe → Fe3+ + 3e O + 2e → O2-
0,15 0,15 0,45 0,075 0,15
N+5 + 3e → N+2
0,1 0,3 0,1
Câu 9. Dãy sắt kẽm kim loại tính năng được HNO3 quánh nguội:
A. Ag, Al, Zn, Cu
B. Ag, Zn, Cu, Mg
C. Fe, Cu, Mg, Zn
D. Mg, Cu, Fe, Zn
Lời giải:
Đáp án: B
Fe, Al, Cr ko tính năng với HNO3 quánh nguội vì thế bị thụ động
3Ag + 4HNO3 → 3AgNO3 + NO + 2H2O
3Zn + 8HNO3→ 3Zn(NO3)2 + 2NO + 4H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Câu 10. Hoà tan 15,6 gam lếu phù hợp bột Al và Mg nhập hỗn hợp HCl dư. Sau phản xạ lượng hỗn hợp axit gia tăng 14 gam. Khối lượng nhôm và magie nhập lếu phù hợp đầu là:
A. 2,7 gam và 1,2 gam
B. 5,4 gam và 2,4 gam
C. 5,8 gam và 3,6 gam
D. 10,8 gam và 4,8 gam
Lời giải:
Đáp án: D
Áp dụng tấp tểnh luật bảo toàn lượng tao có: mH2 = 15,6 - 14 = 1,6 gam
Mặt không giống theo gót công thức 1 và theo gót đề tao sở hữu hệ phương trình:
(Khi nhập cuộc phản xạ Al nhượng bộ 3 e, Mg nhượng bộ 2 e và H2 thu về 2 e)
3.nAl+ 2.nMg = 2.nH2 = (1)
27.nAl +24.nMg = 15,6 (2)
Giải phương trình (1), (2) tao sở hữu nAl= 0,4 mol và nMg = 0,2 mol
Từ cơ tao tính được mAl = 27.0,4 = 10,8 gam và mMg = 24.0,2 = 4,8 gam
Câu 11. Cho lếu phù hợp bột X bao gồm 0,04 mol Fe và 0,015 mol Cu tính năng với oxi ở nhiệt độ phỏng cao nhận được 3,24 g lếu phù hợp Y. Cho Y tan không còn nhập hỗn hợp chứa chấp 0,12 mol HCl và 0,035 mol HNO3 thu được một,05 khí NO độc nhất và hỗn hợp Z (không chứa chấp NH4+) . Thêm hỗn hợp AgNO3 dư nhập Z nhận được m gam hóa học rắn. thạo những phản xạ xẩy ra trọn vẹn, N (5+) chỉ bị khử trở thành NO, độ quý hiếm của m là :
A. trăng tròn,73
B. 41,46
C. 34,44
D. 40,65
Lời giải:
Đáp án: A
Qui lếu phù hợp Y về: Fe; Cu; O
Bảo toàn khối lượng: mFe + mCu + mO = mY
=> nO(Y) = 0,0025 mol
Ta thấy : nNO = nHNO3 => Sau phản xạ không thể NO3- nhập hỗn hợp.
Bảo toàn O: nO(Y) + 3nHNO3 = nNO + nH2O => nH2O = 0,0725 mol
Bảo toàn H: nHCl + nHNO3 = nH+(X) + 2nH2O
=> nH+ dư = 0,01 mol
Bảo toàn năng lượng điện nhập X: 2nFe2+ + 3nFe3+ + 2nCu2+ + nH+ = nCl-
Mặt không giống nFe2+ + nFe3+ = 0,04 mol
=> nFe2+ = 0,08; nFe3+ = 0
Khi cho tới AgNO3 vào :
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,0075 ← 0,01
Fe2+ + Ag+ → Fe3+ + Ag
0,0325
Cl- + Ag+→AgCl
0,12
=> m = trăng tròn,73 g
Câu 12. Hoà tan không còn 9,4 gam lếu phù hợp Fe; FeO; Fe3O4; Fe2O3 nhập hỗn hợp HNO3 quánh giá dư được một,68 lít khí NO2 (đktc, thành phầm khử duy nhất) và hỗn hợp Y. Cô cạn hỗn hợp Y được m gam muối bột. Giá trị của m:
A. 64,90
B. 60,50
C. 30,25
D. 65,30
Lời giải:
Đáp án: B
Ta quy thay đổi trở thành Fe và O
Fe0 → Fe3+
N5+ → N4+
O0 → O2−
Bảo toàn mol e: 3nFe = nNO2 + 2nO
⇔3nFe= 0,15 + 2nO
56nFe + 16nO= 9,4
nFe = 0,125 (mol)
nO = 0,15 (mol)
nNO3−= 3nFe= 0,375 (mol)
⇒mFe(NO3)3 = mFe + mNO3− = 0,125.56 + 0,375.62 = 30,25 (g)
Câu 13. Nung m bột Cu nhập oxi, sau 1 thời hạn nhận được 14,8 gam lếu phù hợp hóa học rắn A bao gồm (Cu, CuO, Cu2O). Hòa tan lếu phù hợp A nhập HNO3 quánh, giá vừa phải đầy đủ nhận được 3,36 lít khí NO2 (đktc, thành phầm khử duy nhất) và hỗn hợp B. Giá trị của m là:
A. 41,6
B. 19,2
C. 25,6
D. 12,8
Lời giải:
Đáp án: D
chỉ bảo toàn e tao có: = + 0,15.1 => m = 12,8 gam
Câu 14. Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau Lúc các phản ứng xảy rời khỏi hoàn toàn, thu được dung dịch A. Cô cạn dung dịch A thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
A. 9,75
B. 8,75
C. 7,80
D. 6,50
Lời giải:
Đáp án: A
Xem Fe3O4 là FeO.Fe2O3
Ta có: nFeCl2 = = 0,06 (mol)
Phương trình phản ứng
FeO + 2HCl → FeCl2 + H2O
0,06 0,06
⇒ nFe2O3= = 0,03 mol
Phương trình phản ứng
Fe2O3 + 6HCl → 2FeCl3+ 3H2O
0,03 0,06
⇒ mFeCl3 = 0,06. 162,5 = 9,75 (g)
Câu 15. Để khử trọn vẹn 6,08 gam lếu phù hợp A bao gồm những oxit Fe sau: FeO, Fe3O4, Fe2O3, cần thiết 2,24 lít khí H2(đktc). Mặt không giống hoà tan trọn vẹn 6,08 gam lếu phù hợp A nhập hỗn hợp H2SO4 quánh giá thì nhận được thể tích V (ml) SO2 (đktc). Giá trị V(ml) là:
A. 112 ml
B. 224 ml
C. 336 ml
D. 448 ml.
Lời giải:
Đáp án: D
Quy thay đổi lếu phù hợp A về lếu phù hợp nhị hóa học FeO và Fe2O3 với số mol là x, y
Ta có: Phương trình phản ứng
FeO + H2 → Fe + H2O (1)
x → x → x
Fe2O3 + 3H2 → 2Fe + 3H2O (2)
y → 3y → 2y
Có: x + 3y = 0,1 và 72x + 160y = 6,08
=> x = 0,04 mol; hắn = 0,02 mol
Phương trình phản ứng
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O (3)
0,04 → 0,02 mol
Vậy VSO2 = 0,02. 22,4 = 0,448 lít hoặc 448 ml
Câu 16. Cho hỗn hợp NaOH nhập ống thử đựng hỗn hợp FeCl3, hiện tượng kỳ lạ để ý được là:
A. Có kết tủa White xanh rờn.
B. Có khí bay rời khỏi.
C. Có kết tủa đỏ lòm nâu.
D. Kết tủa white color.
Lời giải:
Đáp án: C
Cho hỗn hợp NaOH nhập ống thử đựng hỗn hợp FeCl3, xẩy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓nâu đỏ + 3NaCl
Fe(OH)3 kết tủa red color nâu
Câu 17. Nhiệt phân một lượng MgCO3 sau đó 1 thời hạn nhận được hóa học rắn A và khí B. Hấp thụ không còn khí B vị hỗn hợp NaOH nhận được hỗn hợp C. Dung dịch C vừa phải tính năng được với BaCl2, vừa phải tính năng với KOH. Hòa tan hóa học rắn A vị hỗn hợp H2SO4 loãng dư nhận được khí B và hỗn hợp D. Xác tấp tểnh bộ phận của D
A. MgSO4, H2SO4 dư
B. MgSO4
Xem thêm: Lý thuyết Tích vô hướng của hai vectơ lớp 10 (hay, chi tiết).
C. H2SO4 dư
D. NaHCO3 và Na2CO3
Lời giải:
Lý thuyết kết hợp với bài tập về cách vẽ và lập phương trình đường parabol toán lớp 10.
Chu trình KREB
HẰNG SỐ ĐIỆN MÔI LÀ GÌ ?
Tin nhanh Việt Nam và thế giới hôm nay, liên tục cập nhật tin tức online 24h từ các báo và trang tin điện tử hàng đầu
Bài học giúp các em thấy được một mối tình trong vô vọng thấm đượm nỗi buồn, nhưng ở đây là nỗi buồn trong sáng của m