Bảng tính tan hóa 9
Hóa học tập lớp 9: Bảng tính tan chất hóa học được VnDoc biên soạn, ra mắt cho tới chúng ta học viên nằm trong quý thầy cô tìm hiểu thêm là bảng tính tan SGK Hóa 9, hao hao cơ hội học tập nằm trong bảng tính tan một cơ hội sớm nhất có thể. Từ bại liệt vận dụng nhập giải những nội dung bài bác tập dượt.
Bạn đang xem: Bảng tính tan Hóa học Chi tiết đầy đủ
>> Mời chúng ta tìm hiểu thêm thêm thắt một trong những nội dung tương quan.
- Muối này tại đây ko tan nhập nước
- Dãy bao gồm những muối bột đều tan nội địa là
- Kim loại này tại đây tan trọn vẹn nội địa dư
- Cặp oxit phản xạ với nước ở sức nóng chừng thông thường tạo nên trở nên hỗn hợp bazơ là
I. Chất tan và hóa học ko tan
Ở nhập nước có chất tan và chất ko tan, có chất tan ít, có chất tan nhiều.
Tính tan của một số axit, bazo, muối
(Cách học tập nằm trong bảng tính tan)
Bảng tính tan của Axit: Hầu hết axit tan được nhập nước, trừ axit silixic.
Bảng tính tan của Bazo: phần lớn các bazo ko tan nhập nước, trừ một số như: KOH, NaOH,..
Bảng tính tan của Muối:
- Những muối natri, kali đều tan.
- Những muối nitrat đều tan.
- Phần lớn các muối clorua, sunfat tan được. Nhưng phần lớn các muối cacbonat ko tan.
II. Độ tan của một hóa học nhập nước
1. Định nghĩa chừng tan
Độ tan (kí hiệu là S) của một nhập nước là số gam chất đó hòa tan nhập 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
2. Những yếu tố hình họa hưởng đến độ tan
Độ tan của một hóa học tùy theo nhiều yếu ớt tố: sức nóng chừng, áp suất, thực chất của hóa học.
Với hóa học rắn, tùy theo sức nóng chừng, thông thường sức nóng chừng tăng thì chừng tan tăng.
Ví dụ: Khi hoà tan lối nhập ly nước rét lối tiếp tục tan thời gian nhanh rộng lớn Khi hoà tan nhập ly nước giá buốt.
Với hóa học khí, Khi tăng sức nóng chừng hoặc rời áp suất thì chừng tan rời.
3. Ý nghĩa bảng tính tan
Bảng tính tan mang đến tao biết, tính tan những hóa học nhập nước: hóa học này tan được nội địa, hóa học này ko tan nội địa, hóa học này không nhiều tan nội địa, hóa học này dễ dàng phân diệt, cất cánh khá …Từ bại liệt tao hoàn toàn có thể thực hiện những bài bác nhận ra và những việc đem kiến thức và kỹ năng tương quan.
Thí dụ: Nhận biết hỗn hợp muối bột Fe (III) vì chưng hỗn hợp NaOH tạo nên trở nên kết tủa gray clolor đỏ au Fe(OH)3
FeCl3 + 3NaOH → Fe(OH)3 ↓ + 3NaCl
III. Bảng tính tan SGK Hóa 9
Bảng tính tan hóa học
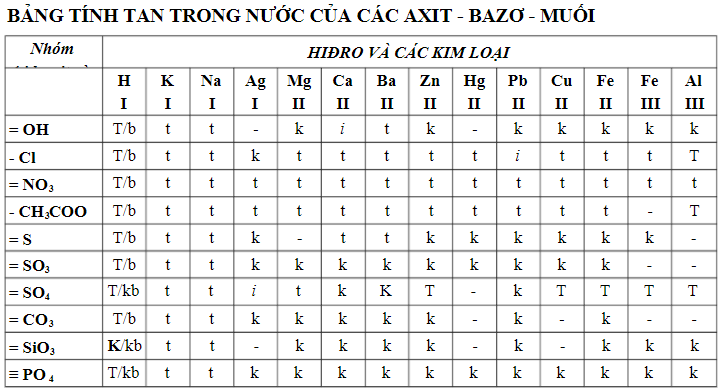
- t: Hợp hóa học dễ dàng tan nhập nước
- i: Hợp hóa học không nhiều tan
- k: Hợp hóa học thực tiễn ko tan
- -: Hợp hóa học ko tồn bên trên hoặc bị phân diệt nhập nước
- b: Hợp hóa học cất cánh khá hoặc dễ dàng phân diệt trở nên khí cất cánh lên
- kb: Hợp hóa học không mờ hơi
IV. Bảng tính tan của muối
| STT | Hợp chất | Đều | Trừ |
| 1 | Muối nitrat (NO3-) | Đều tan | |
| 2 | Muối axetat (CH3COOH-) | Đều tan | |
| 3 | Muối clorua (Cl-) Muối bromua (Br-) Muối Iotua (I-) | Đều tan | AgCl: Kết tủa trắng PbCl2: Ít tan (tan nội địa nóng) CuCl, HgCl (Hg2Cl2) AgBr: Kết tủa color vàng AgI: Kết tủa vàng đậm, HgI2 (đỏ) |
| 4 | Muối florua (F-) | Không tan | trừ muối bột sắt kẽm kim loại kiềm, nhôm, bạc, thiếc, thủy ngân |
| 5 | Muối sunfat (SO42-) | Đều tan | BaSO4, CaSO4, PbSO4 (kết tủa trắng) Ag2SO4 (ít tan) Hg2SO4 |
| 6 | Muối Sunfua (S2-) | Không tan | Trừ muối bột sunfua của sắt kẽm kim loại kiềm (Na, K) và amoni (NH4+) |
| 7 | Muối Sunfit (SO32-) | Không tan | Trừ muối bột sunfit của sắt kẽm kim loại kiềm (Na, K) và amoni (NH4+) |
| 8 | Muối cacbonat (CO3)2- | Không tan | Trừ muối bột cacbonat của sắt kẽm kim loại kiềm (Na, K) và amoni (NH4+) |
| 9 | Muối Photphat (PO43-) | Không tan | Trừ muối bột Photphat của sắt kẽm kim loại kiềm (Na, K) và amoni (NH4+) |
>> Tài liệu tìm hiểu thêm chi tiết : Muối là gì? Tính hóa chất của muối
V. Màu sắc của một trong những Hidroxit ko tan
- Cu(OH)2: kết tủa xanh lơ lam
- Fe(OH)2: kết tủa lục nhạt
- Fe(OH)3: kết tủa nâu đỏ
- Mg(OH)2: kết tủa white ko tan nhập kiềm dư
- Al(OH)3, Zn(OH)2, Pb(OH)2, Sn(OH)2: kết tủa white tan nhập kiềm dư.
>> Tài liệu tìm hiểu thêm chi tiết: Nhận biết color của những hóa học hóa học
VI. Cách Học Thuộc Bảng Tính Tan Đơn Giản Nhất
Việc học nằm trong bảng tính tan kha khá khó khăn và mất quá nhiều thời hạn những em học viên mới nhất ghi nhớ không còn và nhiều Khi thực hiện vẫn nhần. Vì thế nhiều cách thức và được nghĩ về rời khỏi sẽ giúp những em dễ dàng nắm bắt dễ dàng ghi nhớ rộng lớn lúc học về bảng tính tan Hóa Học. VnDoc đang được tổ hợp lại canh ty chúng ta, hãy theo dõi dõi phần nội dung tiếp sau đây nhé.
Tuy nhiên những cách thức bại liệt đơn thuần phương án tương hỗ, hỗ trợ. Việc cần thiết nhất vẫn chính là ở chủ yếu những em học viên, chịu thương chịu khó, kiên trì thực hiện nhiều bài bác tập dượt, nhiều dạng khác nhau bài bác về tính chất tan sẽ hỗ trợ những em ghi nhớ lâu và ghi nhớ sâu sắc.
1. Cách 1. Tính tan của muối bột
Loại muối bột tan vớ cả
là muối bột ni tơ rat
Và muối bột a xê dịch tat
Bất kể sắt kẽm kim loại nào
*
Những muối bột đa số tan
Là clorua, sunfat
Trừ bạc chì clorua
Bari, chì sunfat
*
Những muối bột ko hoà tan
Cacbonat , photphat
Sunfua và sunfit
Trừ kiềm, amoni.
2. Cách 2. Bài thơ tính tan của những hóa học hóa học
Bazơ, những chú ko tan: Đồng, nhôm, crôm, kẽm, mangan, Fe, chì.
Ít tan là của Canxi
Magiê cũng chẳng năng lượng điện ly dễ dàng dàng
Muối sắt kẽm kim loại I đều tan
Cũng như Nitrat và “nàng” hữu cơ
Muốn ghi nhớ thì nên thực hiện thơ!
Ta thực hiện thì nghiệm lúc này test coi,
Kim Loại I, tao biết rồi,
Những sắt kẽm kim loại không giống tao “moi” rời khỏi tìm
Photphat nhập nước “đứng im” ( Trừ sắt kẽm kim loại I)
Sunphat một trong những “im lìm trơ trơ”:
Bari, chì với S – r
Ít tan bao gồm bạc, “chàng khờ” Canxi,
Còn muối bột Clo – rua thì Bội nghĩa đành kết tủa, anh chì cố tan (Giống muối bột Br, I)
Muối không giống thì ghi nhớ dễ dàng dàng:
Gốc SO3 chẳng tan chút nào! ( Trừ sắt kẽm kim loại I)
Thế còn gốc S thì sao? (Giống muối bột cacbonat)
Nhôm ko tồn bên trên chú nào thì cũng tan
Trừ đồng, thiếc, bạc mangan,
Thủy ngân, kẽm, Fe ko tan nằm trong chì
Đến trên đây thì đang được đầy đủ đua,
Thôi thì chúc các bạn ngôi trường gì rồi cũng vô!
3. Cách 3 : Rút gọn gàng của bảng tính tan, dễ dàng học tập, dễ dàng nhớ
3.1. Tính tan nội địa của những muối bột :
1. Các muối bột axit sau đều dễ dàng và đơn giản tan nội địa (Ví dụ: CaHCO3, NaHCO3, KHS, NaHSO3, NaHS …), muối bột axetat (gốc -CH3COO), muối bột nitơrat (có gốc =NO3)
2. Các muối bột cacbonat (gốc =CO3) đa số đều ko tan nội địa trừ một trong những muối bột của sắt kẽm kim loại kiềm (Na2CO3, Li2CO3, K2CO3, …) thì tan được. Riêng một trong những sắt kẽm kim loại như Hg, Fe(III), Cu, Al ko tồn bên trên dạngmuối cacbonat hoặc bị phân huỷ tức thì nhập nước
Các muối bột Photphat (có gốc =PO4) đa số đều ko tan (trừ muối bột của sắt kẽm kim loại kiềm)
Các muối bột Sunfit ( đem gốc =SO3) ko tan nội địa (trừ muối bột của sắt kẽm kim loại kiềm) và muối bột Fe(III) , Al ko tồn bên trên dạng muối bột sunfit
Gần tựa như những muối bột Silicat (gốc =SiO3) ko tan (trừ muối bột của sắt kẽm kim loại kiềm) và nhập bại liệt Ag, Cu, Hg ko tồn bên dưới dạng muối bột Silicat
3. Gần như toàn bộ những muối bột đem gốc F-, Cl-, Br-, I- đều tan được nội địa trừ AgCl, AgI, AgBr là ko tan được; PbCl2 tan vô cùng không nhiều và muối bột AgF ko tồn tại
4. Gần tựa như những muối bột dạng sunfat (gốc = SO4) đều tan nội địa trừ BaSO4, SrSO4, PbSO4 ko tan; Ag2SO4, CaSO4 không nhiều tan nội địa và Hg ko tồn bên trên bên dưới dạng muối bột sunfat
5. Các muối bột gốc sunfu (gốc =S) thường rất khó khăn tan trừ những muối bột của sắt kẽm kim loại kiềm và kiềm thổ (K2S, Na2S, BaS, CaS…) thì tan được và Mg, Al ko tồn bên trên bên dưới dạng muối bột sunfu
3.2. Tính tan chất hóa học của bazơ:
Các Bazơ của sắt kẽm kim loại kiềm ( Na, Li, K) đều tan, Bazơ của sắt kẽm kim loại kiềm thổ tan không nhiều (Ca, Ba). Hợp hóa học NH4OH tan, sót lại đều ko tan.
3.3. Tính tan nội địa của axit
Gần như toàn bộ những phù hợp hóa học axit đều tan và dễ dàng và đơn giản cất cánh khá. H2SiO3 thì ko tan
VII. Câu chất vấn bài bác tập dượt áp dụng liên quan
1. Câu chất vấn trắc nghiệm
Câu 1. Axit ko tan nội địa là
A. H2SO4
B. H3PO4
C. HCl
D. H2SiO3
Câu 2. Cặp hóa học này tại đây nằm trong tồn bên trên nhập dung dịch?
A. HCl và NaNO3
B. HCl và Ca(OH)2
C. H2SO4 và BaCl2
D. NaOH và H2SO4
Câu 3. Dãy bao gồm bazơ tan nội địa là:
A. NaOH, Ca(OH)2, LiOH và Zn(OH)2
B. KOH, Ba(OH)2, Cu(OH)2 và Zn(OH)2
C. NaOH, CaOH)2, Cu(OH)2 và KOH
D. NaOH, KOH, Ca(OH)2 và Ba(OH)2
Xem thêm: Công thức tính chu vi hình tam giác và các bài tập minh họa
Câu 4. Kết luận này đúng lúc nói tới muối
A. Muối clorua đều là muối bột tan
B. Muối Fe là muối bột tan
C. Muối của sắt kẽm kim loại kiềm đều là muối bột tan
D. AgCl là muối bột tan
Câu 5. Muối ko tan nội địa là
A. Na2S
B. NaNO3
C. K2CO3
D. HgS
Câu 6. Dãy bao gồm hóa học ứng dụng được với hỗn hợp CuCl2 là
A. NaOH, K2SO4 và Zn
B. NaOH, AgNO3 và Zn
C. K2SO4, KOH và Fe
D. HCl, Zn và AgNO3
Câu 7. Cặp hóa học Khi phản xạ ko tạo nên hóa học khí.
A. Na2SO3 và HCl
B. NH4Cl và KOH
C. Na2SO4 và BaCl2
D. BaCO3 và HCl
Câu 8. Cho kể từ từ hỗn hợp KOH cho tới dư nhập hỗn hợp AlCl3 thấy xuất hiện
A. xuất hiện nay kết tủa blue color.
B. xuất hiện nay kết tủa keo dán giấy white, tiếp sau đó kết tủa ko tan.
C. xuất hiện nay kết tủa keo dán giấy white, tiếp sau đó kết tủa tan dần dần.
D. xuất hiện nay kết tủa blue color, tiếp sau đó kết tủa tan dần dần.
Câu 9. Cho những mệnh đề sau:
1) Các muối bột nitrat đều tan nội địa và đều là hóa học năng lượng điện li mạnh.
2) Ion NO3- đem tính lão hóa nhập môi trường thiên nhiên axit.
3) Khi sức nóng phân muối bột nitrat rắn tao đều nhận được khí NO2.
4) Hầu không còn muối bột nitrat đều bền sức nóng.
Các mệnh đề đích thị là:
A.(1), (2), (3).
B. (2) và (4).
C.(2) và (3).
D.(1) và (2).
Câu 10. Nhỏ kể từ từ hỗn hợp H2SO4 nhập ống thử đựng Cu(OH)2 thấy?
A. Cu(OH)2 không tan
B. Cu(OH)2 tan dần dần, hỗn hợp ko color.
C. Cu(OH)2 tan dần dần, hỗn hợp blue color lam và đem khí cất cánh ra
D. Cu(OH)2 tan dần dần, hỗn hợp làm nên màu xanh lơ lam.
2. Đáp án thắc mắc trắc nghiệm
| 1 D | 2 A | 3 D | 4 C | 5 D |
| 6 B | 7 C | 8 C | 9 D | 10 D |
3. Câu chất vấn tự động luận
Câu 1. Có 4 hóa học rắn: KNO3, NaNO3, KCl, NaCl. Hãy nêu cơ hội phân biệt bọn chúng.
Hướng dẫn giải cụ thể bài bác tập
Đem nhóm khuôn test 4 hóa học rắn:
Ngọn lửa thay đổi màu sắc vàng tươi: NaNO3 và NaCl
Ngọn lửa thay đổi màu sắc tím đỏ: KNO3 và KCl
Dùng hỗn hợp AgNO3:
Ống nghiệm này xuất hiện nay kết tủa white → NaCl và KCl
NaCl (dd) + AgNO3 (dd) → NaNO3 (dd) + AgCl (r)
KCl (dd) + AgNO3 (dd) → KNO3 (dd) + AgCl (r)
còn lại → NaNO3 và KNO3
Câu 2. Chỉ người sử dụng 1 hóa hóa học này tại đây nhằm nhận ra những dung dịch: NH4Cl, KOH, KCl, H2SO4, K2SO4, Ba(OH)2?
Hướng dẫn giải cụ thể bài bác tập
Dùng hỗn hợp quỳ tím tao phân thành 3 nhóm
- Nhóm (I): quỳ tím hóa đỏ au : NH4Cl, H2SO4
- Nhóm (II) quỳ tím hóa xanh: KOH, Ba(OH)2
- Nhóm (III): quỳ tím ko thay đổi màu: KCl, Na2SO4
Cho thứu tự từng hóa học ở group (II) vào cụ thể từng hóa học ở group (I)
| NH4Cl | H2SO4 |
KOH | Khí hương thơm khai | Không hiện nay tượng |
Ba(OH)2 | Khí hương thơm khai | Kết tủa trắng |
Cho Ba(OH)2 nhận ra được vào cụ thể từng hóa học ở group (III), hóa học tạo nên kết tủa white là K2SO4, hóa học ko hiện tượng kỳ lạ là KCl
Câu 3. Cho những hóa học sau: Na2SO4, Al(OH)3, Al2O3, NaHCO3, (NH4)2CO3 , CuSO4, Na2CO3, HNO3, BaCl2. Các hóa học ứng dụng đối với cả nhì hỗn hợp NaOH và hỗn hợp HCl, ghi chép phương trình phản xạ.
Hướng dẫn giải cụ thể bài bác tập
Dãy bao gồm những hóa học có công dụng đối với cả nhì hỗn hợp NaOH và hỗn hợp HCl là Al(OH)3, Al2O3, NaHCO3, (NH4)2CO3.
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
NaHCO3 + NaOH → Na2CO3 + H2O
NaHCO3 + HCl → NaCl + CO2 + H2O
(NH4)2CO3 + 2NaOH → Na2CO3 + 2NH3 + 2H2O
(NH4)2CO3 + 2HCl → 2NH4Cl + CO2 + H2O
Câu 4. Có 4 ống thử, từng ống chứa chấp 1 hỗn hợp muối bột (không trùng sắt kẽm kim loại hao hao gốc axit) là: clorua, sunfat, nitrat, cacbonat của những sắt kẽm kim loại Ba, Zn, K, Pb.
a) Hỏi từng ống thử chứa chấp hỗn hợp của muối bột nào?
b) Nêu cách thức phân biệt 4 ống thử đó?
Hướng dẫn giải cụ thể bài bác tập
a) Ta đem những ống thử sau: K2CO3, Pb(NO3)2, MgSO4, BaCl2.
Giải mến. Lọ K2CO3 là nên đem vì thế gốc CO3 2- kết phù hợp với những gốc sắt kẽm kim loại Ba, Mg, Pb đều tạo nên kết tủa ko tạo nên hỗn hợp.
b) Phân biệt:
Cho HCl nhập 4 dung dịch: K2CO3, Pb(NO3)2, ZnSO4, BaCl2.
→Tạo khí: K2CO3
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
Không hiện nay tượng: Pb(NO3)2, ZnSO4, BaCl2: Nhóm A
Cho dd NaCl nhập group A:
+ Tạo kết tủa: Pb(NO3)2:
2NaCl + Pb(NO3)2 → PbCl2↓ + 2NaNO3
+ Không hiện nay tượng: ZnSO4, BaCl2: Nhóm B
Cho tiếp hỗn hợp Na2SO4 nhập group B:
→ Tạo kết tủa: BaCl2:
Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
→ Không hiện nay tượng: ZnSO4.
.........................................
Xem thêm: [LỜI GIẢI] Trong hệ SI, đơn vị của từ thông là - Tự Học 365
Mời chúng ta tìm hiểu thêm thêm thắt tư liệu liên quan
- Bài tập dượt Hóa học tập 9: Chương 2 Kim loại
- Hóa học tập lớp 9: Nhận biết - Phân biệt những chất
Trên trên đây VnDoc đã mang cho tới chúng ta cỗ tư liệu vô cùng hữu ích Bảng tính tan chất hóa học, canh ty những chúng ta cũng có thể ghi chép đích thị phương trình phản xạ, những hóa học có công dụng cùng nhau hay là không, kể từ bại liệt áp dụng giải những dạng bài bác tập dượt thắc mắc tương quan. Để đem thành phẩm cao hơn nữa nhập học hành, VnDoc van lơn ra mắt cho tới chúng ta học viên tư liệu Chuyên đề Toán 9, Chuyên đề Vật Lí 9, Lý thuyết Sinh học tập 9, Giải bài bác tập dượt Hóa học tập 9, Tài liệu học hành lớp 9 tuy nhiên VnDoc tổ hợp và đăng lên.
Ngoài rời khỏi, VnDoc.com đang được xây dựng group share tư liệu học hành trung học cơ sở không lấy phí bên trên Facebook: Luyện đua lớp 9 lên lớp 10. Mời chúng ta học viên nhập cuộc group, nhằm hoàn toàn có thể sẽ có được những tư liệu tiên tiến nhất.